Tension de la pile
Si l'ensemble de l'enthalpie libérée par la réaction pouvait être retrouvée sous forme d'une différence de potentiel, la tension Eth délivrée par la pile serait:
En fait, d'après le second principe de la thermodynamique, la part correspondant à l'entropie ne peut être transformée en travail électrique. Or, le travail est égal à la variation d'enthalpie libre au cours de la réaction chimique.
Le travail récupérable correspond au déplacement des électrons dans le circuit extérieur. Il est égal à:
avec Ea et Ec les potentiels à l'anode et à la cathode. Le travail maximal récupérable par la pile (quand les pertes peuvent être négligées) est donc:
La tension maximale récupérable est donc Erev:
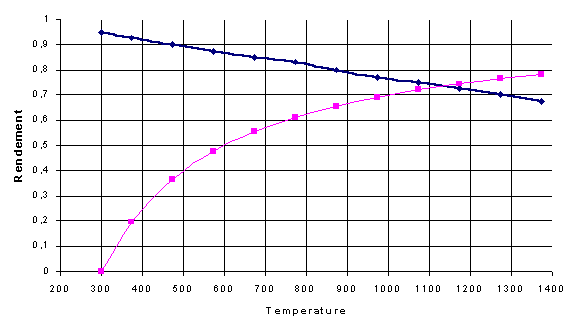
La variation d'entropie étant négative (diminution du nombre de moles), la tension maximale aux bornes de la pile diminue quand la température augmente. Le rendement théorique de la pile, soit le rapport entre Erev et Eth, diminue donc lui aussi en fonction de la température.
La différence entre le potentiel
de la cathode et celui de l'anode représente en fait la fem de
la pile:
Le potentiel de chaque électrode
s'obtient grâce à la loi de Nernst qui le relie à la concentration
des réactifs et produits de la réaction électrochimique ayant lieu à l'électrode.
Pour la réaction:
on a un potentiel (par rapport à l'électrode d'hydrogène (= 0 à 25°C)) :

où les a représentent les activités des espèces Red et Ox.
Lorsque le courant est non nul, la
tension de la pile sera inférieure à cette tension d'équilibre. Ceci est
dû à la présence de surtensions aux électrodes. Elles proviennent des
cinétiques réactionelles dont les vitesses ont des valeurs finies.