Les brevets au service de l'innovation, une nécessité ?
Le développement des génériques a permis à de nombreux patients d'accéder à un traitement apriori efficace et peu cher.
Pourquoi a-t-on besoin d’innovation ?
Les premiers traitements contre le VIH se sont développés à partir de 1987, avec l’essai d’un traitement par l’AZT et la création en parallèle de l’association Act Up. Depuis, de nombreuses découvertes ont été faites, avec un tournant en 1995 via l’apparition des trithérapies (Encyclopaedia Universalis, 2014).
Le flux des nouvelles molécules dans le cas du VIH est continu, comme l’indique Maurice Cassier, directeur de recherches au CNRS et spécialiste des questions de santé publique et propriété intellectuelle. Cette évolution est notamment due à l’influence historique des associations de malades et ONG des pays du Nord. Monsieur Cassier, dans l’entretien que nous avons pu obtenir avec lui, souligne ce point : « Le SIDA a une configuration sociologique particulière. Le SIDA a beaucoup frappé les pays du Nord; des catégories intellectuelles ont extrêmement bien structuré ces mouvements. » (Cassier, entretien, 14 mars 2014)
L’innovation passe par 2 types de besoins : des nouveaux traitements, et des traitements optimisés. Ce double besoin est confirmé par le Dr Paul De Lay, directeur exécutif adjoint du Programme de l’ONUSIDA, lorsqu’il affirme que : « Nous prévoyons que l'optimisation des médicaments se fera en plusieurs phases qui incluront l'optimisation des traitements existants, avec une diminution des doses et des fréquences le cas échéant, et la mise en place de nouvelles technologies émergentes, dont le test de la charge virale et des CD4 sur les lieux de soins, la prochaine génération de traitements de première et deuxième intention peu onéreux mais hautement efficaces, et la première génération de thérapie antirétrovirale injectable de longue durée. » (De Lay, 2011)
• Besoin de nouveaux traitements
A ce jour, aucun traitement curatif n’a été mis au point. Dans le cas des traitements contre le VIH, on distingue pour le moment trois générations de médicaments antirétroviraux. Cependant, les patients développent une résistance aux traitements : de nouvelles générations doivent voir le jour, d'autant plus que le nombre de patients traités par des antirétroviaux augmente de manière significative, comme le montre le graphe ci-dessous:
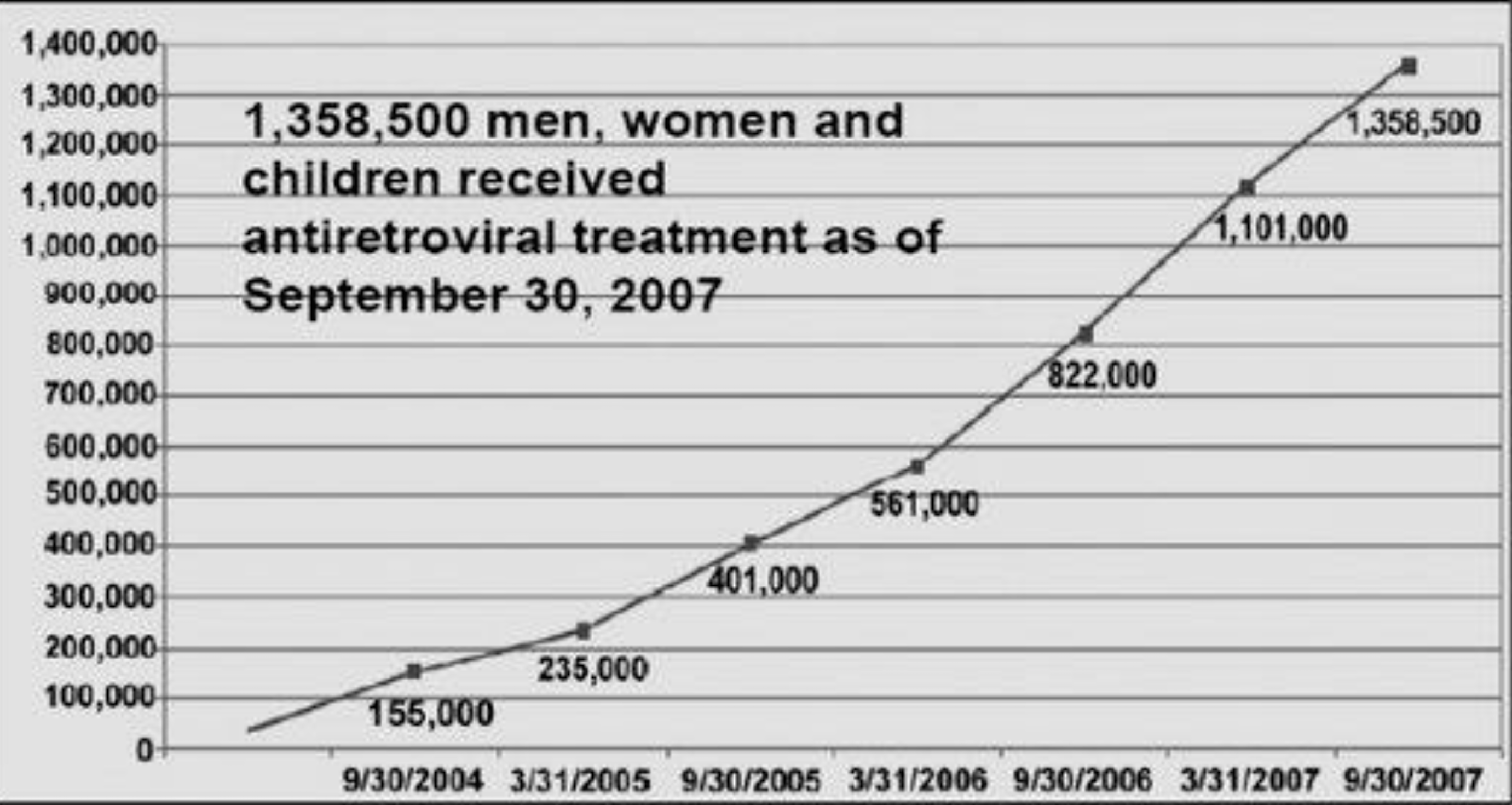
Evolution du nombre de patients traités par le programme PEPFAR: 15 pays cibles
D'après le Health Matrix Journal of Law-Medicine : "Les malades vivant avec le VIH développent une résistance accrue aux médicaments antirétroviraux de première génération. Ils devront par conséquent commencer à prendre les médicaments de deuxième et troisième génération, dont la plupart sont encore brevetés " « People living with HIV/AIDS are increasingly developing resistance to first-generation ARV drugs. They will therefore need to start taking second- and third-generation drugs, most of which will still be patented. » (Jain, Darrow, 2013 : 439).
• Besoin de traitements optimisés
L'innovation dans le mode d'administration des traitements est également à prendre en compte. Une amélioration dans ce domaine peut consister à réduire le nombre de comprimés à prendre par jour, via le regroupement des trithérapies en une seule gélule. La firme de génériques Cipla a par exemple travaillé sur ce regroupement des prises de traitement (Cassier, entretien, 14 mars 2014).
Il y a donc un réel besoin d'innovation, et ce dans tous les aspects du traitement de la maladie : à la fois dans l'efficacité des molécules mais aussi dans les voies d’administration. La question est maintenant de savoir s’il faut protéger ces innovations, et si oui, comment ?
Pourquoi protéger la propriété intellectuelle ?
• L’innovation doit être protégée
Pour les industries pharmaceutiques, c’est l’apparition du système de brevets qui a permis d’accéder à de telles avancées dans la recherche de traitements. C’est ce qui est affirmé dans un rapport du CRS -CRS: Congressional Research Service, est une agence fédérale américaine dépendant du congrès des états unis. Il fait de la recherche sur les politiques publiques et publie régulièrement des rapports considérés comme pointus et objectifs. , Congressional Research Service, intitulé « Patent Evergreening : Issues in Innovation and Competition » :
« The patent laws promote both original and improvement inventions, that most technological advance occurs incrementally, that improvements may be developed by competitors of the original innovator, that many improvement patents cover advances that are of considerable medical significance, and that patents on improvements may not impede the ability of competitors to market products that were covered by expired patents on original technologies ». (Thomas, 2009)
Les brevets existent, par définition, dans le but de protéger la propriété intellectuelle d'une entité. Dans un exposé fait à la 15ème conférence internationale sur le sida, Monsieur McKinnell, chef de la direction de Pfizer Inc, une multinationale pharmaceutique, reste ferme sur le sujet : « Nous ne consentirons toutefois pas à ce que certains s’approprient notre technologie pour la revendre à profit ». (Canada NewsWire, 13 juillet 2004)
Dans le cas des traitements contre le VIH, les grandes industries pharmaceutiques déposent des brevets, pas seulement sur le produit qui a été développé, mais également sur la méthode de synthèse de ces médicaments, ou encore sur le mode d'administration. Il peut donc y avoir de multiples brevets posés sur la même molécule ou le même traitement. Pour les grands groupes pharmaceutiques, les brevets sont nécessaires dans le but de compenser le coût de la recherche. On voit bien l'impact de ce coût en pratique, puisqu'il y a eu par exemple la fusion de deux grands groupes, Aventis et Sanofi en 2004 dans le but de réduire les coûts de la recherche en regroupant les laboratoires (d’après un rapport de Sanofi : http://m-fr.sanofi.com/).
Mme Gro Harlem Brundtland, directrice générale de l’OMS affirme même, d’après l’article « Droit des brevets ou droit à la santé ; quand l’OMS épouse la cause des firmes pharmaceutiques » paru dans Le Monde Diplomatique :
« Nous devons protéger les droits des brevets (...) pour garantir que la recherche-développement nous fournira les outils et les technologies nouvelles (...). Nous avons besoin de mécanismes pour empêcher la réexportation de médicaments à bas prix vers des économies plus riches. » (Motchane, juillet 2002)
Si l’innovation doit être protégée, on est en droit de se demander sur quels critères accorder cette protection, et s’ils sont légitimes.
• Mais sur quels critères ?
Il n’y a pas à proprement parler de critères internationaux. Par exemple, selon le Code américain (US Code), page 2 :
« An invention that constitutes a “process, machine, manufacture, or composition of matter” may be patented. It must also be novel, or different, from subject matter disclosed by an earlier patent, publication, or other state-of-the-art knowledge. In addition, an invention is not patentable if “the subject matter as a whole would have been obvious at the time the invention was made to a person having ordinary skill in the art to which said subject matter pertains.”[…] The invention must also be useful, a requirement that is satisfied if the invention is operable and provides a tangible benefit. » (Thomas, 13 novembre 2009).
Cependant, il existe une législation qui régule le dépôt de brevets, différente pour chaque pays.
Pour l'Inde par exemple, lorsqu'un brevet a été déposé, sa validité se juge selon plusieurs critères : l'invention brevetée permet-elle de réduire l'impact de la maladie ? Le prix du médicament est-il raisonnable ? Le brevet est-il en cours d'étude en-dehors de l'Inde ? L'effort entrepris dans la conception du médicament est-il suffisant ? (Jain, 2013 : 437)
Depuis le 1er janvier 1995, les accords ADPIC ADPIC: Accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce, TRIPS en anglais, est un texte annexé à l’accord instituant l’Organisation Mondiale du commerce. Il est entré en vigueur le 1er janvier 1995 et applique les principes du système commercial aux droits de propriété intellectuelle. Il a été ratifié en 1996 au Brésil et en 2005 en Inde. sont entrés en vigueur dans une grande majorité des pays signataires. Cet accord pose notamment la question de savoir comment assurer une protection adéquate des droits de propriété intellectuelle. Étant donné les modifications que l'accord impose au système de protection de chaque pays (incluant notamment une extension de la durée des brevets à 20 ans et une obligation de breveter les molécules thérapeutiques), il a été donné entre 10 et 20 ans de période de transition avant d'accepter l'accord aux pays moins développés. Ces accords, bien que proposant une manière de protéger les droits de propriété intellectuelle, ne donnent pas d’informations sur la nature de la propriété à protéger. On est donc en droit de se demander quels types d’innovation il faut protéger.
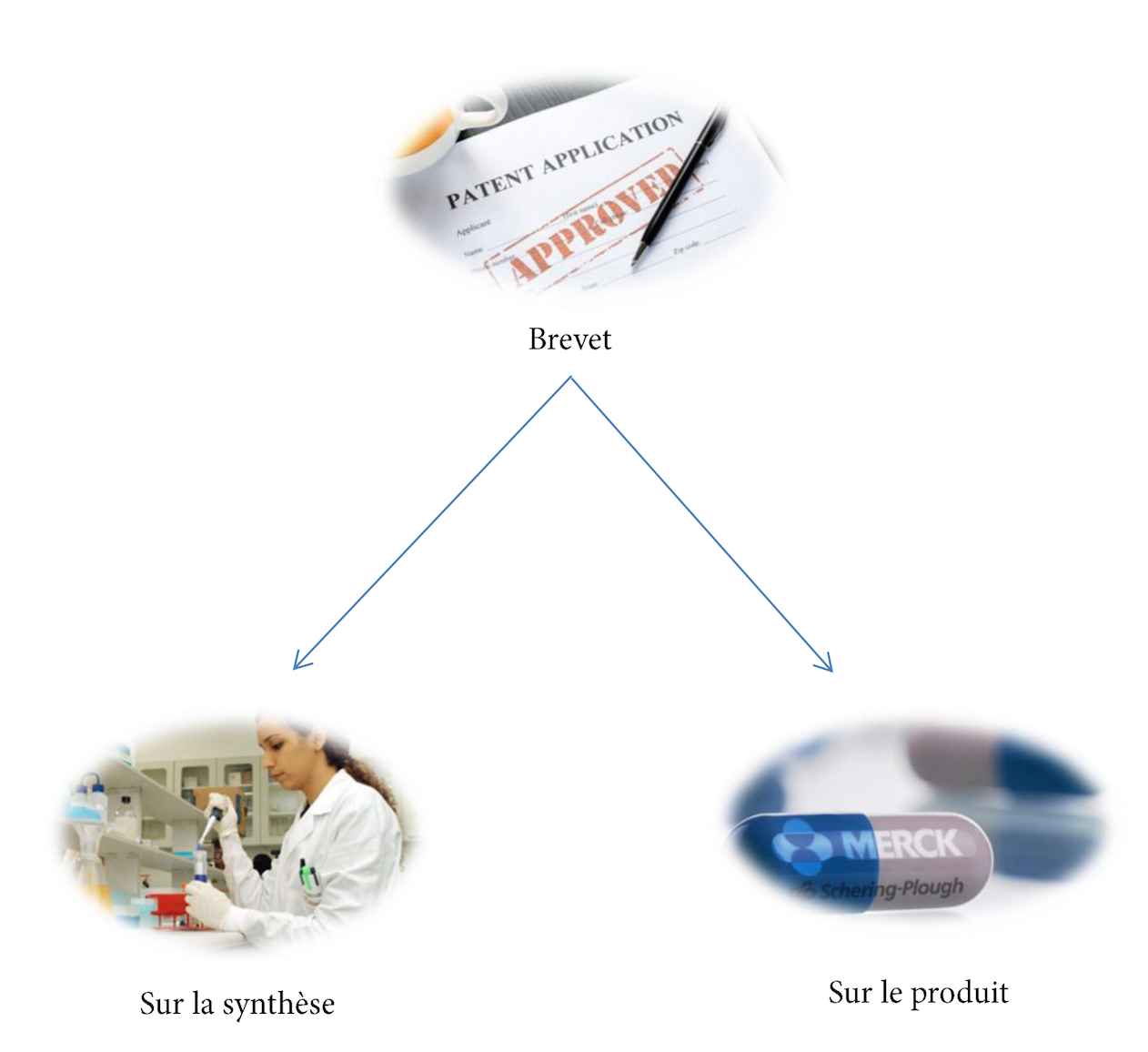
Différents types de brevets
En pratique, on distingue deux types de brevets : les brevets sur les produits et les brevets sur les procédés. La différence majeure entre ces deux types de brevets est que lorsqu’une firme pharmaceutique dépose un brevet sur un produit, alors personne d’autre ne peut synthétiser son produit.
Les accords ADPIC répondent à cette question de manière radicale, puisqu’ils affirment que : « la brevetabilité des molécules thérapeutiques est devenue obligatoire dans tous les membres signataires ». (Orsi, 2007 : 77).
S'il est naturel de considérer que les grandes industries pharmaceutiques sont les principales sources d'innovation, il convient cependant de ne pas négliger l'innovation provenant des industries de génériques. Les grandes industries pharmaceutiques ne sont donc pas les seules à utiliser des brevets.