Une preuve scientifique discutable
 Au vu de différentes études détaillées précédemment (cf. les nombreux risques sanitaires), les effets néfastes seraient donc prouvés ! Pourquoi donc continue-t-on d’utiliser ces substances dans notre nourriture ?
Au vu de différentes études détaillées précédemment (cf. les nombreux risques sanitaires), les effets néfastes seraient donc prouvés ! Pourquoi donc continue-t-on d’utiliser ces substances dans notre nourriture ?
En réalité, la toxicité n’est pas établie de façon catégorique. M. Eric Gaffet (chercheur au CNRS et ancien président des comités d’experts de l’Anses sur les nanoparticules) nous a indiqué au cours d’un entretien qu’il convient de manipuler les résultats des études scientifiques avec un certain recul, et d’en évaluer la pertinence avant de les prendre pour acquises :
Pourquoi dire qu’il y a des risques ? Les résultats de la littérature scientifique montrent des dangers, mais uniquement dans certaines conditions très précises.
Eric Gaffet (entretien), chercheur au CNRS et ancien président des comités d’experts de l’Anses sur les nanoparticules
D’abord, les études scientifiques faites sur la toxicité des nanoparticules ne sont pas si nombreuses que cela, et représentent seulement 8% de la taille des études totales faites dans le domaine des nanotechnologies [1] . Ensuite, qui dit expérience scientifique dit conditions simulées en laboratoire et d’après Mr Gaffet, qui rejoint l’avis public de l’Anses[2][9] (rapports de 2010 et 2014), ces conditions expérimentales sont peu transposables à l’homme principalement du fait de deux critères : la dose et le voie d’exposition.
L’Anses[3] (2017) et l’étude Titanium Dioxide Nanoparticles in Food and Personal Care Products[19] s’accordent à dire que la dose moyenne de dioxyde de titane (TiO2) nanoparticulaire à laquelle s’expose l’homme est de 0.2 à 1 mg/Kg de masse corporelle pour les adultes, et jusqu’à 2 à 3 mg/Kg de masse corporelle pour les enfants (en raison de l’utilisation fréquente de cette substance dans les bonbons). Or, une grande partie des études effectuées précédemment exposaient les animaux de laboratoires à des doses massivement supérieures à ces taux. Voici à titre d’exemple les doses employées dans quelques études menées sur des rats et concluants à la toxicité potentielle des nanoparticules :
| Etude | Particule | Dose utilisée |
|---|---|---|
| Wang et Al de 2013 [5] | Dioxyde de titane TiO2 | 10 à 200 mg/Kg par jour pendant 30 jours |
| Tarantini et Al de 2015 [6] | Dioxyde de silice SiO2 | Jusqu’à 40mg/Kg |
| Ramadan et Al de 2015 [7] | Dioxyde de titane TiO2 | 5 à 500mg/Kg |
| Shahare et Al de 2013 [8] | Argent | 5 à 20mg/Kg |
Ainsi, les expérimentations sont souvent le reflet d’une exposition aiguë à des doses importantes, et non d’une exposition chronique à des faibles doses comme c’est le cas de l’exposition humaine.[11]
L’Anses[2] estime donc que les conclusions de ces études, qui suggèrent des effets toxiques sur les animaux testés, sont peu pertinentes quant à leur transposition à l’homme, dont l’exposition est bien plus faible.
Cependant, certaines études récentes s’imposent de travailler à des doses beaucoup plus réalistes et proches de celles qui sont humainement possibles (Bettini et Al[4] Hong et Al[18]…).
D’après « Cancer Environnement », les principales voies d’exposition de l'homme aux nanoparticules, en toute généralité, sont les voies pulmonaire (par inhalation), intra-nasale, cutanée et digestive (ou orale, par ingestion). Mais en ce qui concerne les nanoparticules dans l'alimentation, il est bien sûr majoritairement question de la voie digestive (ou orale). Or, toujours selon les rapports de l’Anses[10] (communiqué de 2009), cette voie d’exposition est la moins documentée et les informations dont on dispose sur le devenir et la réactivité des particules ingérées est mal connue. Ainsi, le communiqué de 2009 explique qu’« on ne connaît pas précisément les modifications que subissent les nanoparticules dans le tube digestif, en particulier si elles restent libres ou si elles s’agrègent, si elles adsorbent des bio-molécules présentes dans la matrice alimentaire ou elles sont transformées par les enzymes digestifs… ».
Il est également important de noter que la quasi-totalité des études sur la voie orale ont été faites ces trois dernières années (de 2014 à 2016), et que les auteurs de chacune de ces études admettent eux-mêmes que leur étude est motivée par un manque d’informations sur cette voie d’exposition privilégiée pour l’homme.
Par ailleurs, toujours selon l'Anses, les conclusions peuvent être contradictoires et les interprétations variées. D’abord, la distribution des particules dans le corps diffère d’un modèle à l’autre et d’une étude à l’autre. De plus, les caractéristiques physico-chimiques des nanoparticules testées et leur interaction avec la matrice alimentaire sont insuffisamment documentées. Tous cela fait que ces études ne permettent de conclure ni à un effet dose ni à un effet taille (ou à une interaction entre les deux).
Un autre argument phare et récurrent pour limiter la répercussion des conclusions de ces études, est le fait que les méthodes de détection et de caractérisation du risque sont loin d’être infaillibles, ni même reconnues. Mme Francelyne Marano (professeur émérite de toxicologie et membre du haut conseil de la santé public) commente le fait que beaucoup d'études ont des résultats contradictoires : certaines ne détectent pas du tout de nanoparticules dans l'organisme des animaux, alors que d'autres mettent en évidence leur présence et leurs effets.
Les études réglementaires se font sur la base de protocoles, correspondant à des directives européennes ou des guidelines de l’OCDE. Les études sont faites sur des protocoles inchangés depuis longtemps pour certains (40/50 ans).[...]Les industriels font uniquement ce qui est obligatoire, et les tests sont inadaptés. [...] Il faut avoir des outils spécialisés pour détecter les passages de barrières (biologiques), ce ne sont pas les demandes réglementaires. Les publications de recherches ne sont pas comparables car chacun a son approche et son hypothèse mais il faut quand même les intégrer dans l’évaluation des risques.
Francelyne Marano (entretien), professeur émérite de toxicologie et membre du haut conseil de la santé public (HCSP)
Au niveau de la détection, la grande réactivité des nanomatériaux et leurs mutations et changements selon la matrice dans laquelle ils sont introduits font qu’ils sont difficiles à détecter et à suivre. Ce manque de stabilité des propriétés physico-chimiques qu’on observe rend les méthodes d’analyse complexes et coûteuses, d’autant plus qu’on manque de protocoles de références pour des comparaisons fiables. Ce point de vue est à la fois partagé par l’Anses et l’EFSA[14] (rapport de l’EFSA de 2009). Selon ces deux organismes, aucune généralisation sans preuve ne peut être de confiance, et seule une étude au cas par cas permettrait de caractériser sans aucune ambiguïté une substance. Seulement, c’est là que figure le dilemme, car « selon certaines études, près de cinquante ans seraient nécessaires uniquement pour tester la toxicité de tous les nanomatériaux actuels ; les tests sur seulement deux mille substances par an pourraient coûter 10 milliards de dollars, et nécessiteraient le sacrifice d'un nombre considérable d'animaux de laboratoire chaque année », comme le souligne la journaliste Angela Bolis dans son article du Monde ‘’Nanoparticules : l'ingrédient qui s'est discrètement invité à notre table.’’[15] Rajoutons à cela le fait que les nanomatériaux intégrés dans un produit ne seront pas forcément émis à l'extérieur du produit lors de sa durée de vie. De plus, les matériaux changent de caractéristiques au cours de leur cycle de vie, ce qui rend les données à l’entrée insuffisantes pour évaluer les risques à la sortie [20]…
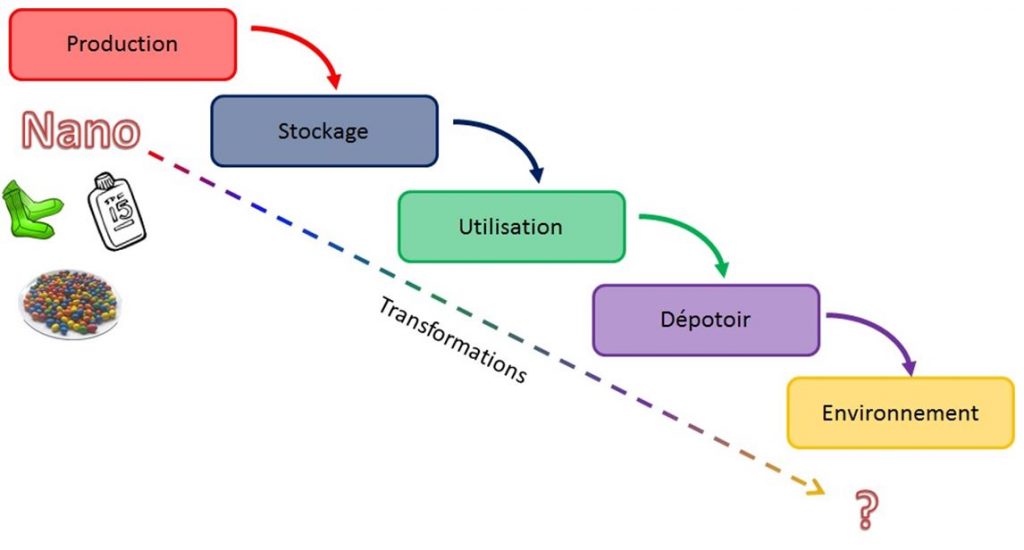
Cycle de vie des nanos dans les produits communs
En ce qui concerne la toxicité, « les méthodes d'évaluation de la toxicité des substances chimiques conventionnelles ne sont pas directement transposables aux nanomatériaux.», précise Fabienne Gauffre dans son article ''Les nanoparticules, un défi pour les toxicologues''[12]. Ainsi, par exemple, la masse ne serait pas le paramètre déterminant pour caractériser la toxicité de ces substances, mais plutôt la taille (Selon l’Anses[10] ) ou la surface spécifique (Selon l’article Reprotoxicité des nanoparticules[11] ). Cela nous ramène au problème en amont : celui de la définition. Sur quoi donc s'appuyer pour spécifier ces substances? (voir la page sur la définition) Dans son journal de 2011[16], l’EFSA souligne qu’il n'y a actuellement pas de méthode in vitro validée pour l’évaluation des risques des nanoparticules. Enfin, tout cela pris en considération, n’oublions pas que les organismes animal et humain peuvent ne pas réagir de la même manière aux particules. Dans tous les cas, l’avis de 2017[3] critique l’étude de Bettini et al.[4] sur la toxicité du TiO2, en jugeant que le nombre d’animaux testés n’est pas suffisant pour conclure à un risque de cancer.
De façon générale, l’Anses (agence nationale, française), dans ses différents rapports, se refuse à reconnaître de manière catégorique les différents effets néfastes supposément provoqués par les nanomatériaux testés. Elle appelle néanmoins à la précaution. Quant à l’EFSA (agence européenne), elle conclut clairement dans son journal de 2016[17] qu’au vu des données disponibles, le taux d’absorption humain de TiO2 par exemple est très bas (0.1% au maximum) et que par conséquent, des effets génotoxiques de ce produit sont fortement peu probables. Cela va dans le sens de ce que nous a dit Mme Laëtitia Guillet, Avocat à la Cour, dans un entretien : la France est souvent plus alarmiste que les autres pays européens sur cette sorte de sujets. Elle était l’un des premiers pays à tirer la sonnette d’alarme pour les nanoparticules. L’EFSA, autorité européenne indépendante, est en général plus mesurée.
Références :
[1] Verdo Y. (2014, 28 avril) Nanomatériaux et santé : le grand flou. in LesEchos.fr. Disponible sur https://www.lesechos.fr/28/04/2014/LesEchos/21677-045-ECH_nanomateriaux-et-sante—le-grand-flou.htm [Consulté le 13/06/2017]
[2] Agence française de sécurité sanitaire de l’environnement et du travail. (2010) Les nanomatériaux : Évaluation des risques liés aux nanomatériaux pour la population générale et pour l’environnement. Rapport réalisé pour la Direction générale de la santé, la Direction générale de la prévention des risques et la Direction générale du travail, 208 pages. Disponible sur https://www.anses.fr/fr/system/files/AP2008et0005Ra.pdf [Consulté le 13/06/2017]
[3] Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. (2017) Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif à une demande d’avis relatif à l’exposition alimentaire aux nanoparticules de dioxyde de titane. Rapport réalisé pour Direction Générale de la Concurrence, de la Consommation et de la Répression des Fraudes, la Direction Générale de la Santé et la Direction Générale de l’alimentation, 17 pages. Disponible sur https://www.anses.fr/fr/system/files/ERCA2017SA0020.pdf [Consulté le 13/06/2017]
[4] Bettini, S., Boutet-Robinet, E., Cartier, C., et Al. (2017). Food-grade TiO2 impairs intestinal and systemic immune homeostasis, initiates preneoplastic lesions and promotes aberrant crypt development in the rat colon. Scientific Reports, 7, 40373.
[5] Wang, Y., Chen, Z., Ba, T., et Al. (2013). Susceptibility of Young and Adult Rats to the Oral Toxicity of Titanium Dioxide Nanoparticles. Small, 9(9‑10), 1742‑1752
[6] Tarantini, A., Huet, S., Jarry, G., et Al. (2015). Genotoxicity of synthetic amorphous silica nanoparticles in rats following short-term exposure. Part 1: Oral route. Environmental and Molecular Mutagenesis, 56(2), 218‑227.
[7] Mohamed, H. R. H. (2015). Estimation of TiO2 nanoparticle-induced genotoxicity persistence and possible chronic gastritis-induction in mice. Food and Chemical Toxicology, 83, 76‑83.
[8] Shahare, B., Yashpal, M., & Gajendra. (2013). Toxic effects of repeated oral exposure of silver nanoparticles on small intestine mucosa of mice. Toxicology Mechanisms and Methods, 23(3), 161‑167.
[9] Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. (2014) Évaluation des risques liés aux nanomatériaux. Enjeux et mise à jour des connaissances, Disponible sur 196 pages. Disponible sur https://www.anses.fr/fr/system/files/AP2012sa0273Ra.pdf [Consulté le 13/06/2017]
[10] Agence française de sécurité sanitaire des aliments. (2009) Nanotechnologies et nanoparticules dans l’alimentation humaine et animale. Rapport réalisé pour la Direction générale de la Santé, 27 pages. Disponible sur https://www.anses.fr/fr/system/files/RCCP-Ra-NanoAlimentation.pdf [Consulté le 13/06/2017]
[11] Greco, F., Courbière, B., Rose, J., et Al. (2015). Reprotoxicité des nanoparticules. Gynécologie Obstétrique & Fertilité, 43(1), 49‑55.
[12]Les nanoparticules, un défi pour les toxicologues (2015, 08 Septembre) in LeMonde.fr
[14] European Food Safety Authority (2009) The Potential Risks Arising from Nanoscience and Nanotechnologies on Food and Feed Safety. Rapport réalisé pour la Commission européenne, 39 pages.
[15] Bolis A. (2012, 31 décembre) Nanoparticules : l’ingrédient qui s’est discrètement invité à notre table. in LeMonde.fr
[16] European Food Safety Authority (2011) Guidance on the risk assessment of the application of nanoscience and nanotechnologies in the food and feed chain. Rapport réalisé pour la Commission Européenne, 36 pages.
[17] European Food Safety Authority (2016) Re-evaluation of titanium dioxide (E 171) as a food additive. Rapport réalisé pour la Commission Européenne, 83 pages.
[18] Hong, F., Wu, N., Zhou, Y., et Al. (2017). Gastric toxicity involving alterations of gastritis-related protein expression in mice following long-term exposure to nano TiO2. Food Research International, 95, 38‑45.
[19] Weir, A., Westerhoff, P., Fabricius, L., et Al. (2012). Titanium dioxide nanoparticles in food and personal care products. Environmental Science and Technology, 46(4), 2242‑2250.
[20] Mitrano, D. M., Motellier, S., Clavaguera, S., et Al. (2015). Review of nanomaterial aging and transformations through the life cycle of nano-enhanced products. Environment International, 77, 132‑147.
Images
3dman_eu, Question point d’interrogation aide [Dessin 3D] CC0 Public Domain. Disponible sur https://pixabay.com/fr/question-point-d-interrogation-aide-2309040/ [Consulté le 18/06/2017]
Fares Mahjoub, (2017) Cycle de vie des nanos dans les produits communs [Schéma explicatif].