Nina Entelis est Directrice de Recherche dans l’unité Génétique moléculaire, Génomique, Microbiologie de l’Université de Strasbourg en partenariat avec le CNRS.
Dans quel(s) cas le remplacement mitochondrial est-il justifié ?
Les mitochondries sont des éléments présents dans les cellules eucaryotes qui possèdent une double membrane. Elles synthétisent sur cette membrane, l’ATP, qui permet de procurer de l’énergie pour les processus cellulaires. A titre d’ordre de grandeur, les mitochondries d’un homme produisent en moyenne 60 kg d’ATP par jour. Les molécules d’ADN mitochondrial sont très petites devant les chromosomes nucléaires, et ne codent en fait que pour 13 protéines parmi les 1500 présentes dans une mitochondrie. Ces 13 protéines, ainsi que 70 protéines provenant du génome, sont impliquées dans la “chaîne respiratoire” qui permet la synthèse d’ATP. Des mutations dans l’ADN mitochondrial ou dans le génome peuvent donc entraîner un dysfonctionnement de cette chaîne respiratoire ainsi qu’une production d’ATP en-deçà de la normale. Pour certains organes tels que le cerveau, les muscles et le cœur, cette sous-production est fatale.
Il faut bien différencier les maladies mitochondriales, dues à des mutations dans le génome codant pour des protéines des mitochondries, et les maladies d’ADN mitochondrial, dues à des mutations dans l’ADN mitochondrial. Contre ces dernières, il n’existe pas de solution thérapeutique aujourd’hui, car les mitochondries sont des organites très bien protégés du fait de leur double membrane. On ne parvient donc pas à accéder à l’ADN mitochondrial avec des molécules.
Une notion importante pour comprendre les maladies mitochondriales est l’hétéroplasmie : le taux d’hétéroplasmie est le nombre de l’ADNmt portant des mutations pathogéniques par rapport au nombre total del’ADN mt dans la cellule. Jusqu’à 75% de l’ADN mt muté, l’hétéroplasmie n’est pas pathogène. Néanmoins, les enfants d’une femme ayant un taux d’hétéroplasmie non nul peuvent avoir un taux d’hétéroplasmie élevé et pathogène. Même avec une hétéroplasmie de 30% chez la mère, la reproduction peut générer une hétéroplasmie pathogène chez l’enfant.
En fonction du taux d’hétéroplasmie de la mère, différente techniques de prévention peuvent être mises en place. Dans le cas d’une hétéroplasmie faible, une méthode consiste à faire une FIV sur plusieurs ovocytes de la mère et à en garder un qui a un taux d’hétéroplasmie non pathogène pour l’implanter dans l’utérus de la mère (c’est ce qui s’appelle un “diagnostic pré-implantatoire”). Dans le cas d’une hétéroplasmie élevée, le diagnostic pré-implantatoire a une faible probabilité de succès, et c’est dans ce cas que le remplacement mitochondrial, ou transfert pro-nucléaire, est pertinent.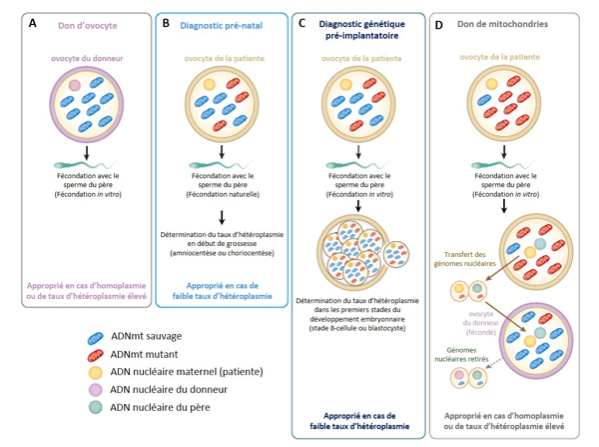
Les différentes options de reproduction proposées pour les femmes porteuses de mutations de l’ADNmt.
(image faite par Romuald Loutre, thésard à l’Université de Strasbourg)
Ces techniques peuvent nécessiter de créer plusieurs embryons pour n’en garder qu’un seul, ce qui peut poser des problèmes éthiques, même si cela est tout à fait légal en France.
Que pensez-vous de l’appellation “bébé à trois parents”, souvent relayée dans les médias ?
En effet, si l’on considère la parenté d’un point de vue génétique, de fait la donneuse donne une partie de son matériel génétique, même s’il ne s’agit que de 13 protéines. Celles-ci sont absolument vitales, le bébé possède donc bien le matériel génétique de trois personnes différentes.
Cependant on peut considérer que les parents sont simplement ceux qui élèvent l’enfant.
Nous avons lu que même avec un remplacement mitochondrial, quelques mitochondries malades peuvent être prélevées avec le noyau. Cela ne met-il pas en péril l’efficacité de la méthode ?
C’est un problème majeur effectivement, l’embryon aura toujours un faible taux d’hétéroplasmie dû à ces mitochondries résiduelles. Mais que cela va-t-il produire lorsque l’enfant va grandir ? Pour l’enfant né au Mexique en 2016, on ne sait pas ce qui va se produire dans ses tissus du fait des mitochondries malades.
Pensez-vous que l’on va réussir à développer la technique de prélèvement du noyau de manière à éliminer ce résidu de mitochondries malade ?
Je ne suis pas sûre. La cellule a une structure très compacte, beaucoup de mitochondries sont proches du noyau. Il est difficile de prélever juste le noyau.
Et concernant un éventuel rejet des mitochondries de la donneuse ?
Oui, le rejet est une possibilité car il existe des interactions entre les mitochondries et le noyau, et plus précisément l’ADN du noyau et l’ADN mitochondrial. Il faut que chaque partie fournisse des protéines dans les bonnes proportions, pour faire fonctionner le complexe respiratoire. La mère et la donneuse doivent avoir le même type d’ADN mitochondrial. Il est possible de faire des tests de caryotypes des mitochondries des deux femmes pour voir si elles sont compatibles ou non.
A quelle fréquence deux femmes ont-elles un ADN mitochondrial incompatible ? Quelle est la probabilité de rejet ?
Bien sûr tout cela est théorique, nous n’avons pas beaucoup d’expériences à analyser sur des humains. D’autres mécanismes peuvent entrer en jeu dans le rejet.
Sur quels types de cellules travaillez vous et comment percevez-vous le cadre législatif français pour les essais cliniques en matière de génétique et d’embryologie ?
Il est interdit d’effectuer des études de recherche sur des embryons humains. Les chercheurs travaillent donc sur des souris. Mais le problème pour les souris est un peu différent de celui des humains, car si il a un taux d’hétéroplasmie très élevé, l’embryon ou le fœtus meurt avant même la naissance. C’est pourquoi nous n’avons pas vraiment de modèle de souris qui ont une maladie d’ADN mitochondrial, mais nous en avons beaucoup de souris avec des mutations du génome nucléaire.
Dans mon équipe, nous travaillons beaucoup sur les mutations d’ADN mitochondrial, donc nous faisons des études sur des cellules en culture mais nous n’avons pas de modèle animal. Légalement, nous pouvons tester des molécules sur des embryons de souris, mais nous ne pouvons pas aller plus loin. Il y a un peu plus de 2 ans, nous avons posé une demande, avec l’hôpital Necker (l’hôpital des enfants malades) de permission pour travailler sur des embryons humains. Nous avions obtenu une permission il y a un an et demi, mais la Fondation Lejeune a demandé la suspension de cette autorisation. Cela fait maintenant 1 an que nous sommes en procès. Nous sommes donc bloqués.
Pouvez-nous nous expliquer le principe des stratégies thérapeutiques que vous étudiez ?
En effet il faut bien comprendre que le remplacement mitochondrial n’est pas une stratégie thérapeutique, contrairement à ce sur quoi nous travaillons. La question qui se pose est “Comment changer le taux d’hétéroplasmie ?”
Nous étudions l’effet que peuvent avoir certaines molécules sur l’ADN mitochondrial. Il existe différentes approches. Une première méthode consiste à importer des molécules saines dans les mitochondries pour remplacer les molécules mutées. Une autre, sur laquelle nous travaillons spécifiquement, consiste à inhiber la réplication de l’ADN mitochondrial mutée en injectant de l’ARN thérapeutique. Les seuls résultats que nous avons sont sur des cellules mises en culture, pas sur des embryons d’animaux et nous ne pouvons pas encore faire des expériences sur des embryons humains.
Ceci est une restitution partielle des propos de Nina Entelis, et non une transcription exacte de l’entretien.