Un médicament peut-il être efficace pour tous les patients de manière identique ? Ce point de discussion s’interroge sur l’universalité de l’efficacité. Nous verrons que le mode de preuve privilégié par la HAS construit statistiquement un patient « moyen » permettant de déterminer ou non l’efficacité. La conséquence de ce mode de preuve est qu’il uniformise implicitement les effets des médicaments. Or certains acteurs, comme le professeur Ceccaldi, font valoir que la variété des effets des médicaments ne peut être prise en compte sans prendre en considération la variété des patients. Ils réhabilitent par là le rôle du médecin généraliste, seul capable d'effectuer une prise en charge au cas par cas.
Une efficacité universelle?
Les points de discussion précédents ont été consacrés à discuter les critères d’efficacité des médicaments : la pluralité des définitions de l’efficacité médicale, mais aussi l’efficacité économique et l’effet incitatif de l’existence de médicaments dans la prise en charge globale du patient. À partir de tous ces critères, le 11 avril 2017, Marisol Touraine a pris la décision unitatérale, dans un communiqué de presse, de continuer à rembourser les médicaments. Cette mesure s'applique uniformément à tous les malades d'Alzheimer : la nouvelle loi les concerne tous. Pour autant, tous les patients sont-ils égaux face aux médicaments? Peut-on parler d'une efficacité "universelle" qui, comme la loi, serait identique pour tous?
L’idée d’une telle efficacité « globale » des médicaments se retrouve dans la logique du mode de preuve le plus répandu parmi les études scientifiques : la méthode du Randomized Control Trial (RCT), traduite par « essai randomisé contrôlé ».
L'ESSAI RANDOMISÉ CONTRÔLÉ
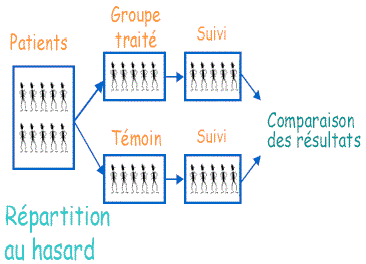
Détaillons le procédé de ce mode de preuve scientifique, déjà cité dans le premier point de discussion. Il s’agit d’un véritable étalon de mesure pour les essais cliniques, devenu presque indispensable au sein de la recherche médicale. La méthode est utilisée pour prévoir les effets d’une ou plusieurs molécules sur la population des patients. Elle cherche à évaluer les effets apportés par le traitement sur le patient, par rapport à une absence de traitement. Pour cela, l’échantillon de patients participants à l’expérience est divisé en deux groupes : un à qui serait administré le traitement, et un autre à qui l’on donnera un médicament placebo, c’est-à-dire identique physiquement au médicament utilisé dans le premier groupe, mais ne contenant pas le principe actif. Ce deuxième groupe est appelé « groupe témoin ». Tout est fait pour éviter les biais : les sujets sont aléatoirement répartis et les évaluateurs et les thérapeutes procèdent, dans la mesure du possible, en aveugle. Le traitement expérimental dure en général plusieurs mois, pendant lesquels les effets sont régulièrement observés sur chaque patient. A la fin du traitement, l’analyse des résultats de l’essai thérapeutique est effectuée grâce à la méthode statistique. Ce sont les tests statistiques qui permettent de conclure l’efficacité du médicament ou non selon les différences observées entre le groupe de patients effectivement traités par le médicament et le groupe témoin. Le résultat est ainsi binaire : si, statistiquement, les effets observés dans le premier groupe sont significatifs par rapport au groupe témoin, alors la molécule testée est déclarée efficace. Si, inversement, ses effets ne sont pas statistiquement significatifs par rapport au placebo, on considère le médicament comme inefficace.
La supposée suppression des biais, par la randomisation et l’anonymisation permet d’affirmer que la seule différence entre les deux groupes provient de l’ingestion ou non du vrai médicament. Dès lors, l’interprétation des résultats est causale : s’il y a une quelconque différence dans les effets entre les deux groupes, elle est liée au médicament, qui est donc considéré comme porteur d’effets réels.
La méthode du RCT construit statistiquement un « patient moyen », un prototype supposé représentatif de la population des malades. Celui-ci permet d'universaliser le résultat d'un essai randomisé contrôlé.
Les biais statistiques propres à la méthode du RCT : l'individu « moyen » peut-il vraiment être représentatif de la population?
Si on creuse la logique du processus, des biais inévitables apparaissent, rendant impossible la généralisation du résultat statistique à l'ensemble de la population des malades. Le RCT, pour fonctionner, implique une démarche expérimentale de fixation d’un certain nombre de paramètres. Ainsi, même en prenant un échantillon très large de patients, comment être sûr qu’il est tout à fait représentatif de la population des personnes atteintes de la maladie d’Alzheimer ? L’essai randomisé contrôlé est tout à fait susceptible d’accueillir des personnes dont le pronostic est meilleur que la moyenne.
Par exemple, les RCT (Randomized Control Trial) excluent parfois les personnes atteintes d’autres pathologies, pour éviter toute interférence de cette autre maladie sur l’expérience. Or, dans la vraie vie, les patients atteints d’Alzheimer peuvent tout à fait être atteints d’autres troubles, qui pourraient influer positivement comme négativement sur les effets du médicament testé. En règle générale, les conditions de l’expérience ne correspondent pas forcément au mode de vie réel des patients, qui lui n'est pas un environnement construit. Un RCT peut par exemple mettre en place des précautions excessives dans le processus d’expérimentation, toujours dans le souci de ne biaiser en aucun cas la procédure, mais s’éloigne ainsi par conséquent du processus réel de prise du médicament par le patient.
METHODE DES RCT ET EFFETS SECONDAIRES
L’essai contrôlé randomisé peut aussi être utilisé pour évaluer d’éventuels effets indésirables des médicaments, concluant ensuite sur leur importance par rapport aux effets bénéfiques, et ainsi sur l’efficacité globale du médicament. Or, les effets indésirables, par définition, touchent seulement un certain nombre de personnes, car sont rattachés à des caractéristiques physiques extérieures (l’âge, le sexe, la présence de pathologies supplémentaires, etc). Dès lors, les effets secondaires les plus rares d’un médicament ont très peu de chances d’être détectés par la méthode des RCT, à moins d’avoir un échantillon très large. De plus, la méthode est coûteuse : l’expérimentation ne peut pas se prolonger sur plusieurs années. Ainsi, les éventuels effets indésirables qui apparaitraient après dix ans de prise du médicament, par exemple, ne seront jamais mis en lumière par cette méthode.
La liste des biais inévitables contenus dans ce mode de preuve est encore longue. On pourrait souligner, là encore, la pluralité des définitions de l’efficacité abordée dans le premier point de discussion, dépendante des critères utilisés dans l’étude, qui empêche de conclure, à partir du seul RCT, sur l' efficacité globale de la molécule étudiée. Un RCT porte toujours une définition particulière de la maladie, éminemment liée à la constitution de l'échantillon.
Exemple d’Essai Randomisé Contrôlé : Randomized, placebo-controlled Trial of the Effects of Donepezil on Neuronal Markers and Hippocampal Volumes in Alzheimer’s Disease, 2003
En 2003, un groupe de chercheurs écrit un article, titré "Randomized, Placebo-Controlled Trial of the Effects of Donepezil on Neuronal Markers and Hippocampal Volumes in Alzheimer’s Disease ». Il porte sur l’efficacité clinique du Donepezil, une des quatre molécules contenues dans les médicaments contre Alzheimer, dans le but d’évaluer son effet sur l’hippocampe, partie du cerveau contenue dans le système limbique (pour plus de précision, voir la vidéo sur la page Quels sont les effets des médicaments ?). Pour cela, ils utilisent la méthode de l’Essai Randomisé Contrôlé. 67 patients ont été sélectionnés, divisés en deux groupes randomisés : un qui prend effectivement le médicament, et un groupe témoin. L’essai clinique a duré vingt-quatre semaines. Les individus sélectionnés devaient répondre à des critères précis comme avoir plus de 50 ans, être atteints de la maladie d’Alzheimer à un stade modéré, ou encore être dans un état général de santé satisfaisant. L’étude conclue que le Donepezil a potentiellement un effet protecteur sur l’hippocampe, donc restreindrait la maladie.
On voit bien ici que le dispositif expérimental du RCT construit un patient atteint d'une maladie d'Alzheimer spécifique : la maladie à un stade modéré qui touche des personnes âgées de plus de 50 ans. Le résultat statistique du test RCT ne peut donc pas prétendre apporter une réponse sur l'efficacité qui soit propre à chaque patient.
Ainsi, le mode de preuve qu'est l'essai randomisé contrôlé, par son fonctionnement statistique qui créé un individu « moyen », supposé représentatif de tous les malades d'Alzheimer, universalise les médicaments et leurs effets, en raisonnant à partir d'une agrégation statistique des données. Cette vision globalisante est remise en cause par plusieurs acteurs de la controverse, qui se positionnent en faveur d'une approche individualisée de l'efficacité.
Une conception « micro » de l'efficacité
Certains acteurs de la controverse, comme l'INESSS (Institut National d'Excellence des Services Sociaux de Santé), le docteur Leicher et le professeur Ceccaldi, se positionnent contre la manière dont les RCT universalisent un individu « moyen », défendant le fait que l’efficacité d’un médicament diffère avec le patient. Dès lors, elle devrait être étudiée non de manière globale, mais au cas par cas. Selon eux, il y aurait une infinité d'efficacités.
On l'a vu, la prise des médicaments contre Alzheimer est fortement liée à la présence d’effets secondaires. Elle nécessite donc de procéder à un arbitrage entre ces effets indésirables et les effets bénéfiques de la molécule sur le patient. Or, selon l’Institut National d’Excellence en Santé et en Services Sociaux (INESSS), dans son rapport de mars 2015, ces effets ne pouvant être appréhendés de manière globale, l’arbitrage coûts/bénéfices associés au médicament se doit d’être fait à l’échelle individuelle.
Cette position a une conséquence principale : la réhabilitation du rôle du médecin généraliste dans l’arbitrage. En effet, une prise de décision au cas par cas s’appuie sur la proximité entre le médecin et chacun de ses patients. Lui seul ayant une relation individualisée avec les patients, est capable de se prononcer sur les effets secondaires et bénéfiques du médicaments pour chacun d’entre eux. Ainsi, l’INESSS, dans son rapport, parle d’une « prise de décision partagée et individualisée suivant une discussion éclairée entre le médecin, le patient et son aidant ». Dès lors, la pertinence ou non d’entreprendre un traitement pharmacologique serait à même d’être décidée dans un cabinet médical, et non par le résultat statistique d’une étude globale de type Essai Randomisé Controlé.
Selon l’INESSS, la décision finale doit relever d’un « processus de décision partagée », c’est-à-dire une participation conjointe du patient, de son aidant et du médecin. Ce dernier aurait alors pour rôle d’exposer aux patients les risques et bénéfices du médicament, selon les données scientifiques disponibles, en lui précisant le degré d’incertitude relatif aux effets du traitement. C’est le patient atteint d’Alzheimer, et éventuellement son aidant, qui trancheraient selon leurs préférences et leurs valeurs. Ce processus de décision, individualisé, remet le patient au centre.
Ce que revendiquent les acteurs qui, comme l’INESSS, prônent une évaluation au cas par cas, c’est une prise de décision décentralisée et à petite échelle, dans le huis clos du cabinet médical, loin de la sphère politique. Ceci repose sur l’idée qu’il n’y a pas une, mais des efficacités, propres à chaque patient.
« Il revient donc au médecin de mettre dans la balance les risques et les bénéfices présumés des options thérapeutiques disponibles pour que le patient et l’aidant soient en mesure de bien comprendre chacune des options. », extrait du rapport de l'INESSS de mars 2015.
« Il s’agit en fait de prendre des décisions à cheval entre la science et la vie subjective du patient », extrait de notre entretien avec le Docteur Claude Leicher.
Les acteurs défendant cette conception sont nombreux : c’est le cas du professeur Ceccaldi, neurologue à Marseille et président de la Fédération Nationale des Centres Mémoire de Ressources et de Recherches (FDCMRR), qui nous a accordé un entretien. Il critique la Commission de Transparence de la Haute Autorité de la Santé (HAS), qui s’appuie sur la méthode des RCT pour clamer l’inefficacité des médicaments. Selon Ceccaldi, ses arguments reposent donc sur le fait que l’efficacité ne serait qu’un « effet statistique » et ne se verrait pas dans la vraie vie. Pour lui, comme pour le docteur Leicher, président du syndicat des médecins généralistes MG France, que nous avons aussi interviewé, l’efficacité se mesure entre deux sphères : la science d’un côté et le patient en tant qu’individu particulier de l’autre.
Les acteurs se positionnant pour une approche localisée de l'efficacité avancent un argument important : l’approche « universelle » de l’efficacité, portée par la méthode des RCT, occulte la distinction entre les patients « répondeurs » et les « non répondeurs ». C'est pourquoi la Fédération Nationale des Centres Mémoire de Ressources et de Recherche, dont le professeur Ceccaldi est directeur, a lancé en 2016 un projet de recherche au niveau national nommé SOS Trial. Celui-ci a pour but d’identifier les « répondeurs », soit les patients sur qui les médicaments contre Alzheimer ont bien des effets. Ceci permettrait de subdiviser les patients en plusieurs catégories, et de cesser ainsi de les considérer comme une masse homogène réagissant de manière uniforme.
« L'efficacité ce n'est pas seulement celle prouvée dans les études ; c'est d'abord celle perçue au quotidien », extrait de notre entretien avec le professeur Matthieu Ceccaldi.
L'association LECMA Vaincre Alzheimer défend la même conception. Selon Catherine Silva, chargée de communication de l'association, avec qui nous avons eu un entretien, la HAS a estimé que l'efficacité des médicaments était "insuffisante", alors que "des effets se montrent sur certains patients". Elle aussi nous fait comprendre qu'une décision globale ne suffit plus : il faut raisonner à l'échelle du patient.
La décision de la Ministre de la Santé de continuer à rembourser les médicaments, dans l'attente de certitudes plus poussées quant à leurs effets, favorise finalement cette approche individualisée. En effet, elle laisse aux médecins le soin de prescrire ou non les médicaments, en fonction des spécificités de chacun. Par sa décision, Marisol Touraine laisse à la sphère médicale une marge de manoeuvre qui permet un ajustement personnalisé, et ainsi la maximisation du bien-être des malades.
Conclusion
Il n’y a donc pas une efficacité médicale des médicaments : elles sont plurielles et relatives à chaque patient. Un individu atteint de la maladie d’Alzheimer ne se définit pas seulement par sa pathologie : chaque patient porte en lui des caractéristiques physiques comme mentales qui le rendent unique. C’est pourquoi on ne peut réduire l’ensemble des malades à une catégorie homogène, que la méthode des essais randomisés contrôlés entend représenter par un individu « moyen ». Des acteurs comme l’INESSS, le professeur Ceccaldi ou encore le docteur Leicher se positionnent au contraire pour une approche au cas par cas. Une vision globale de l’efficacité reviendrait à la définir en amont, dans la sphère de la recherche. Eux préconisent au contraire de l’observer sur le moment, auprès de chaque patient atteint. C’est au médecin généraliste qu’il appartient de faire un arbitrage bénéfices/risques en fonction de chaque malade qu’il examine. Ceci permet de gérer les effets secondaires des médicaments, en adaptant les traitements à chaque cas. La décision politique de la Ministre de la Santé favorise cette approche, laissant aux médecins la possibilité de prescrire les médicaments aux patients pour qui ils seront susceptibles d’avoir des effets bénéfiques.