Dès début 2013, l’histoire de Marion Larat est connue de tous et bouleverse les femmes. De plus en plus de plaintes sont déposées contre les laboratoires qui fabriquent les pilules de 3ème et 4ème génération. Les interview à la télévision et à la radio des victimes et des professionnels de santé se multiplient, et le nombre de travaux de recherche sur ce sujet en France bondit.
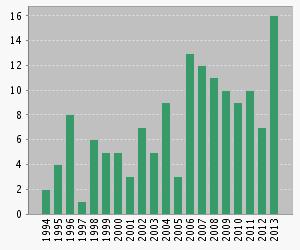
Nombre de publications scientifiques comprenant le terme « contraceptive pill » en France en fonction du temps (Source : Web of Science Citation Report).
Face au scandale médiatique, le Ministère des Affaires sociales et de la Santé, dirigé par Marisol Touraine, demande à l’ANSM et à l’EMA de réévaluer les pilules de 3ème et 4ème génération.
Le rapport de la Caisse nationale de l’Assurance maladie
En juin 2013, l’ANSM publie un rapport réalisé par la Caisse nationale de l’Assurance maladie. Il s’agit d’une étude de cohorte sur 4 millions de femmes de 15 à 49 ans à partir des données du SNIIRAM (Système National d’information Inter régimes de l’Assurance Maladie) et du PMSI (Programme de médicalisation des systèmes d’information). L’objectif de cette étude, réalisée à la demande des autorités sanitaires françaises, est de déterminer, pour les COC de première, deuxième et troisième génération, les risques absolus et relatifs d’événements graves comme l’embolie pulmonaire, l’accident vasculaire cérébral ischémique et l’infarctus du myocarde. L’analyse porte aussi sur le type de progestatif et le dosage d’éthynil-estradiol.
Ce rapport confirme l’existence d’un doublement du risque d’embolie pulmonaire des COC de 3ème génération (COC3G) par rapport à ceux de 2ème génération (COC2G). Le risque d’embolie pulmonaire entre COC2G et COC3G passe en effet de 25 à 50 pour 100 000 personnes. Il met également en évidence l’effet du dosage d’œstrogène : le dosage 30/40 μg d’EE par rapport à celui de 20 μg est à la fois associé à une augmentation de 37% du risque d’embolie pulmonaire mais aussi de 64% du risque d’infarctus du myocarde.
« Au total nos résultats montraient que les progestatifs d’ancienne génération comme le lévonorgestrel (COC2G), combinés à 20 μg d’éthinylestradiol, étaient associés à un moindre risque thromboembolique veineux et artériel. Cette association de 100 μg de lévonogestrel et 20 μg d’éthinylestradiol est commercialisée et remboursée en France ».[1]
Ce rapport est une étude scientifique extrêmement précise qui prend en compte tous les facteurs de risque et arrive à la conclusion que les risques augmentent avec les pilules de 3ème génération. Même s’il ne donne pas de décisions concernant la politique à adopter pour les pilules de 3ème génération, le rapport utilise l’argument scientifique de cette étude pour prouver les risques de ces pilules.
Le rapport de l’EMA
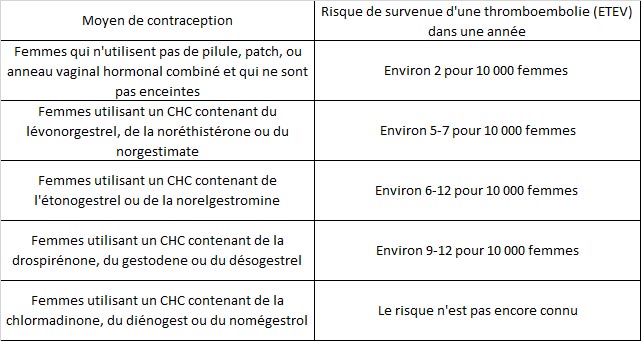
Rendu public le 11 octobre 2013, le rapport de l’Agence européenne du médicament (EMA) juge les effets bénéfiques des pilules de troisième et de quatrième génération supérieurs aux risques. Dans ce même rapport, l’EMA se prononce favorablement sur la poursuite de la commercialisation de ces pilules. Le rapport de l’EMA indique que le nombre d’accidents veineux est évalué à 6 à 12 cas par an pour 100 000 femmes avec les pilules de 3ème génération et de 4ème génération, contre 5 à 7 avec celles de 1ère et 2ème générations.
Après le scandale médiatique, l’EMA a mis à jour des informations sur les contraceptifs pour aider les femmes à prendre des décisions. En novembre 2013, L’EMA termine un examen des contraceptifs hormonaux combinés (CHC). Le Comité des Médicaments à Usage Humain (CHMP) de l’Agence européenne des médicaments a conclu que les bénéfices des CHC pour la prévention des grossesses non désirées restent supérieurs à leurs risques et que le risque de ETEV lié à tous les CHC est faible.
Les conclusions européennes
En juillet 2013, l’ensemble des données disponibles (données d’exposition, données de pharmacovigilance, études pharmaco-épidémiologiques publiées ou non) a fait l’objet d’une analyse par la France et le Royaume- Uni qui étaient en charge de l’évaluation du dossier. Les résultats de celle-ci ont été présentés durant le PRAC (Comité pour l’évaluation des risques en matière de pharmacovigilance) du mois de juillet 2013 et ont à nouveau été examinés en octobre 2013. L’ensemble des membres du comité partagent les conclusions scientifiques suivantes :
- Le rapport bénéfice/risque de chaque COC est favorable
- L’efficacité de tous les COC est identique du point de vue de la contraception. Les données scientifiques disponibles n’apportent pas la preuve d’une différence en termes de tolérance entre les différents COC
- Le risque thromboembolique, bien que faible, est supérieur chez les femmes utilisatrices de COC par rapport à celles qui n’en prennent pas ; les COC contenant du norgestimate (3ème génération) ont un risque équivalent à celui des contraceptifs contenant du lévonorgestrel (2ème génération)
- Les COC contenant du gestodène (3ème génération), du désogestrel (3ème génération) ou de la drospirénone (4ème génération) présentent un sur-risque de thrombose veineuse par rapport à celui des contraceptifs contenant du lévonorgestrel
- Il n’existe pas suffisamment d’études pour documenter le risque des COC contenant du diénogest, de la chlormadinone ou du nomégestrol (toutes de 4ème génération)
- Les différences de risque thromboembolique veineux lié au progestatif sont insuffisamment connues des professionnels de santé et des femmes et les facteurs de risque insuffisamment pris en compte ;
- Le sur-risque généré par les COC contenant du gestodène, du désogestrel ou de la drospirénone en termes d’événements thromboemboliques veineux et de décès au niveau européen a été reconnu. Afin de mieux prendre en compte les différences de risque entre COC, le PRAC a proposé des modifications de l’Autorisation de Mise sur le Marché afin de modifier l’indication, les contre-indications et les précautions d’emploi des COC concernés par la réévaluation. La position française au PRAC de réserver la prescription des pilules de 3ème génération en seconde intention n’a pas été suivie par une majorité des pays européens.
Les recommandations du PRAC ont été confirmées par le CHMP (Committee for Medicinal Products for Human Use) du mois de novembre 2013. Cette position a été soumise à la Commission Européenne. Mais comment les autorités françaises peuvent-elles réagir face à cette conclusion européenne ? Rendez-vous ici.
Source des citations :
[1] : Caisse Nationale de l’Assurance Maladie – COC et risque d’embolie pulmonaire et d’accident artériel – 26 juin 2013 [lien]